医薬品業界
医薬品業界で押さえておくべき、トレーサビリティの法規制
医薬品は人の生命や健康に深く関わるものだけに古くから厳しい法規制が設けられ、その取り扱いには細心の注意が払われてきました。それにもかかわらず、医薬品の投与ミスなどを原因とした医療事故は頻発。こうした事態を改善するために2005年に薬事法の改正が行われました。そして2014年に施行された「薬事法等の一部を改正する法律」により、薬事法は「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」という名称に変更になっています。
医薬品医療機器法(旧薬事法)
医薬品業界ではなじみ深い薬事法ですが、2014年に「薬事法等の一部を改正する法律」により、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」と名称変更になっています。公式では医薬品医療機器法と呼称されるので、当サイト内では医薬品医療機器法で統一します。また、一般的には医薬品医療機器等法や薬機法と呼ばれることもあります。
医薬品や医薬部外品、化粧品、医療機器に関する法律であることは、旧薬事法から変わりませんが、現代の医療事情に合わせてさまざまな項目が付け加えられています。その主な変更点について、薬事法等の一部を改正する法律では、以下のように明記されています。
- 医薬品、医療機器等にかかわる安全対策の強化
- 薬事法の目的に、保健衛生上の危害の発生・拡大防止のため必要な規制を行うことを明示する。
- 医薬品等の品質、有効性および安全性の確保等にかかわる責務を関係者に課す。
- 医薬品等の製造販売業者は、最新の知見に基づき添付文書を作成し、厚生労働大臣に届け出るものとする。
- 医療機器の特性を踏まえた規制の構築
- 医療機器の製造販売業・製造業について、医薬品等と章を区分して規定する。
- 医療機器の民間の第三者機関による認証制度を、基準を定めて高度管理医療機器にも拡大する。
- 診断等に用いる単体プログラムについて、医療機器として製造販売の承認・認証等の対象とする。
- 医療機器の製造業について、許可制から登録制に簡素化する。
- 医療機器の製造・品質管理方法の基準適合性調査について、合理化を図る。
- 再生医療等製品の特性を踏まえた規制の構築
- 「再生医療等製品」を新たに定義するとともに、その特性を踏まえた安全対策等の規制を設ける。
- 均質でない再生医療等製品について、有効性が推定され、安全性が認められれば、特別に早期に、
条件及び期限を付して製造販売承認を与えることを可能とする。
厚生労働省「薬事法等の一部を改正する法律(平成25年法律第84号)」より引用
医薬品が中心だった旧薬事法に対して、医薬品医療機器法では医療機器が別項目で追加され、iPS細胞で注目されている再生医療技術の普及にも配慮した内容になっています。そのほかにも多くの変更点がありますが、こちらではトレーサビリティや医薬品業界にもっとも関連性の高いバーコード表示に絞ってご紹介します。
医療事故防止のための「医療用医薬品へのバーコード表示」
以前から特定生物由来製品および生物由来製品、注射薬(生物由来製品を除く)のアンブルやバイアルについてはバーコード表示が実施されていましたが、2012年付けで厚生労働省により、その内容の一部が改正。医療用医薬品の種類と梱包状態を分類し、その分類に応じて商品コードや有効期限、製造番号、数量などの表示内容を明確化しました。
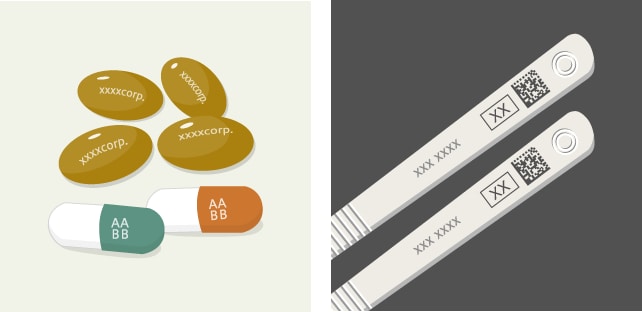
包装形態の単位
| 調剤包装単位 | 製造販売業者が製造販売する医薬品を包装する最小単位 例)アンブル、バイアル、PTPシートなど |
|---|---|
| 販売包装単位 | 卸売販売業者が医療機関などに販売する最小の包装単位 例)10アンブル入りの箱、100シート入りPTPシートの箱など |
| 元梱包装単位 | 製造販売業者が販売包装単位を複数梱包した包装単位 例)販売包装単位の箱が10箱入った段ボールなど |
調剤包装単位のバーコード表示について
| 医療法医薬品の種類 | 実施時期 | 商品コード | 有効期限 | 製造番号 |
|---|---|---|---|---|
|
特定生物由来製品
|
2008年9月(一部2009年9月)
|
●
|
●
|
●
|
|
生物由来製品(特定生物由来製品を除く)
|
2008年9月(一部2009年9月)
|
●
|
○
|
○
|
|
内用薬(特定生物由来製品を除く)
|
2015年7月(一部2016年7月)
|
●
|
○
|
○
|
|
注射薬(特定生物由来製品を除く)
|
2008年9月(一部2009年9月)
|
●
|
○
|
○
|
|
外用薬(特定生物由来製品を除く)
|
2015年7月(一部2016年7月)
|
●
|
○
|
○
|
販売包装単位
| 医療法医薬品の種類 | 実施時期 | 商品コード | 有効期限 | 製造番号 |
|---|---|---|---|---|
|
特定生物由来製品
|
2008年9月(一部2009年9月)
|
●
|
●
|
●
|
|
生物由来製品(特定生物由来製品を除く)
|
2008年9月(一部2009年9月)
|
●
|
●
|
●
|
|
内用薬(特定生物由来製品を除く)
|
2008年9月※
(一部2009年9月) |
●
|
★
|
★
|
|
注射薬(特定生物由来製品を除く)
|
2008年9月※
(一部2009年9月) |
●
|
★
|
★
|
|
外用薬(特定生物由来製品を除く)
|
2008年9月※
(一部2009年9月) |
●
|
★
|
★
|
★は2021年4月実施
元梱包装単位
| 医療法医薬品の種類 | 実施時期 | 商品コード | 有効期限 | 製造番号 |
|---|---|---|---|---|
|
特定生物由来製品
|
2008年9月(一部2009年9月)
|
●
|
●
|
●
|
|
生物由来製品(特定生物由来製品を除く)
|
2008年9月(一部2009年9月)
|
●
|
●
|
●
|
|
内用薬(特定生物由来製品を除く)
|
2021年4月
|
★
|
★
|
★
|
|
注射薬(特定生物由来製品を除く)
|
2021年4月
|
★
|
★
|
★
|
|
外用薬(特定生物由来製品を除く)
|
2021年4月
|
★
|
★
|
★
|
内用薬・外用薬は、調剤包装単位で2015年7月(一部2016年7月)からバーコード表示が実施されました。販売包装単位・元梱包装単位は、2013年9月まで従来のJAN・ITFコードを併記していましたが、2015年7月以降は新バーコード(GS1データバー)のみを表示。内用薬・注射薬・外用薬の販売包装単位および元梱包装単位の有効期限・製造眼号を含んだ新バーコード表示については、2021年4月(ただし、特段の事情があるものについては2023 年4月)以降に製造販売業者から出荷されるものに表示しなければならないと定められています。
新バーコード「GS1データバー」の採用について
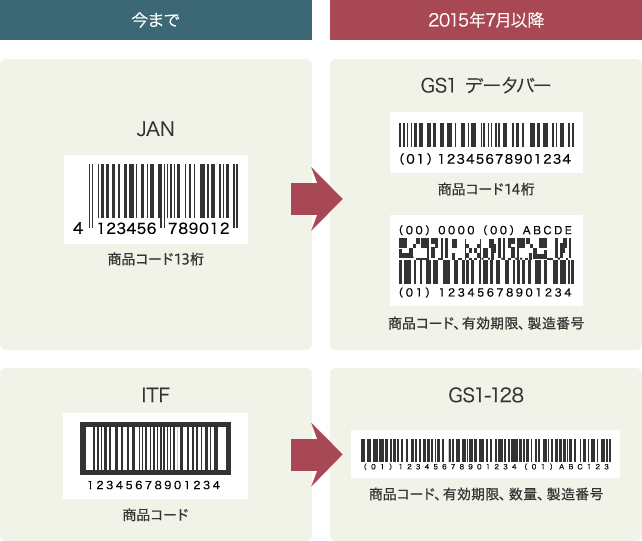
医薬品は色や形状、パッケージ、名称がまぎらわしいものが多く、誤用による医療過誤の原因となっていました。また従来製品では、アラビア数字やアルファベットの組み合わせで製造番号が記載されていたために、「0(ゼロ)」や「1(イチ)」と「I(アイ)」など数字や英字との識別ミスが生じることが往々にしてあり、情報を正しく記録し、保管する上で大きなネックになっていました。
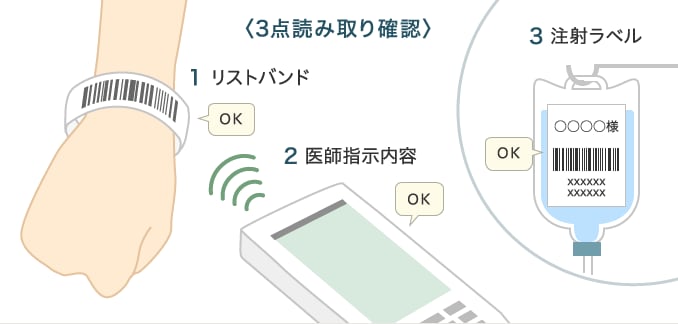
こうした問題解決手段がバーコードによる管理です。すでに以前からJANコードなどが利用されていますが、現在では新バーコードと呼ばれる「GS1データバー」への移行が進められています。新バーコードを使用することで、限られたスペースに商品コードや賞味期限、製造番号などの詳細な情報を格納でき、安全性と確実性が向上。使用時に3点確認を行うことで医療事故防止につながり、医療従事者や流通の負担軽減、トレーサビリティの確保にも有効です。
医薬品製造に関するガイドライン GMP
GMPとは、「Good Manufacturing Practice」の略で、適正製造規範と訳されます。GMPという概念はアメリカで生まれ、世界保健機構(WHO)が「原材料の入荷から製造、最終製品の出荷までの過程において、製品が安全かつ一定の品質を保てること」を考慮してGMPを策定しました。
現在では世界中の法令にGMPが盛り込まれ、日本の医薬品医療機器法(旧薬事法)でもGMP省令が基本になっています。GMPは、医薬品や医療機器など幅広い分野に対応していますが、医薬品GMPでは以下の三原則のもと、保健衛生の向上を目指し、有効性や安全性が高く、高品質な医薬品を提供することを目的にしています。
医薬品GMPの三原則
- 人為的な誤りを最小限にすること
- 汚染および品質低下を防止すること
- 高い品質を保証するシステムを設計すること
GMPガイドラインが定めている内容は製造管理・品質管理に加え、製剤開発、品質リスクマネジメント、品質システムなど医薬品製造など多岐にわたります。そのためトレーサビリティシステムとも関連性が高い省令と言えるでしょう。
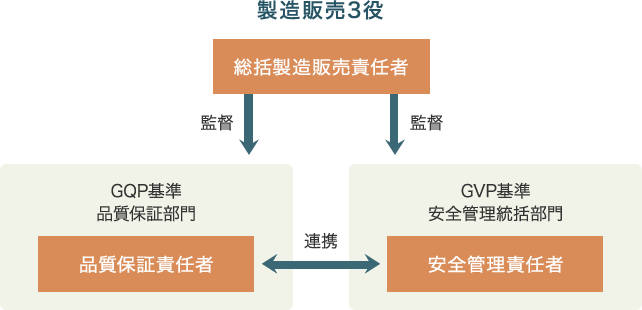
品質と安全に関する基準 GQPとGVP
医薬品や医薬部外品をはじめ、化粧品、医療機器などを流通させる場合、製品の品質を保証し、使用者の安全を確保しなければいけません。そこで品質保証と安全管理の体制が重要になります。そこで医薬品医療機器法(旧薬事法)では、GQP・GVPを取り入れています。
GQPとは、「Good Quality Practice」の略で、製品の品質保証の基準です。医薬品の製造業者は、外部委託や外部製造にかかわらず、製造から市場出荷まで含めて、手順書や記録方法などを定めて体制を整える必要があります。簡単に言えば、製造管理・品質管理の基準と言えます。
一方でQVPは、「Good Vigilance Practice」の略で、安全管理の基準を指します。GQPが製造工程や出荷方法などを定めていることに対し、QVPは製造販売後の安全管理について定めています。GQPでも市場販売後の調査・報告義務などの品質不良に対する項目はありますが、GVPは副作用や感染症などの安全管理を基本にしています。例えば、ユーザーからのコメントやクレームの受付、それらの情報分析、対策などがGVPでは求められます。